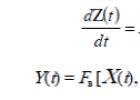Sistemos būklę apibūdinantys kiekiai , pvz., temperatūra, slėgis, tūris ir kt., paskambinsime būsenos parametrai .
Mes vadinsime sistemos būseną nepusiausvyra , jei bent vienam iš būsenos parametrų negalima priskirti konkrečios reikšmės .
Jei visi sistemos būsenos parametrai turi tam tikras vertes, kurios savavališkai ilgą laiką išlieka pastovios fiksuotomis išorinėmis sąlygomis, tada sistemos būsena vadinama pusiausvyra .
Sąvoka " tam tikras vertybes “ tai reiškia parametro reikšmė yra vienoda visuose nagrinėjamos sistemos taškuose . Pavyzdžiui, temperatūra klasėje, griežtai kalbant, skirtinguose taškuose skiriasi, o tai reiškia neturi konkrečios reikšmės . Nepriimtina vidutinę vertę laikyti apibrėžta verte. Jei kambarys yra izoliuotas nuo išorinių poveikių, tada po kurio laiko temperatūra visuose jos taškuose išsilygins ir tada bus galima kalbėti apie tam tikrą kambario temperatūros reikšmę. Panašios idėjos taikomos slėgiui, tankiui ir kitiems sistemos būsenos parametrams.
Perėjimas sistema iš vienos būsenos į kitą vadinama procesas .
Akivaizdu, kad bet kurio proceso metu sistema pereina nepusiausvyros būsenų seką. Tačiau kuo lėtesnis procesas, tuo sistemos būsenos proceso metu arčiau pusiausvyros. Riboje, jei procesas vyksta be galo lėtai, t.y. jis yra kvazistatinis, galime daryti prielaidą, kad bet kuriuo momentu sistemos būsena yra pusiausvyra.
A-prioras pusiausvyra paskambino procesas, susidedantis iš nuolatinės pusiausvyros būsenų sekos . Tai akivaizdu Pusiausvyra gali būti tik kvazistatinis procesas.
Svarbi pusiausvyros procesų savybė yra ta, kad jie gali būti vykdomi atvirkštinė kryptis, t.y. nuo pabaigos iki pradžios per atvirkštinę būsenų seką, o dėl tiesioginių ir atvirkštinių procesų sistemoje ir aplinkiniuose kūnuose jokių pokyčių neįvyks. Todėl procesai, turintys šią savybę – ir jie gali būti tik pusiausvyros procesai – taip pat vadinami grįžtamasis .
Sąlygos kvazistatinis, pusiausvyrinis ir grįžtamasis termodinaminių procesų atžvilgiu jie iš esmės yra sinonimai, tačiau kiekvienas iš jų pabrėžia savo esminį aprašomo proceso požymį.
Patirtis tai rodo nuo išorinių poveikių izoliuota sistema pereina iš nepusiausvyros į pusiausvyros būseną. Šis procesas vadinamas atsipalaidavimas sistema, o jos trukmė yra atsipalaidavimo laikas .
Išskirti žiedinis procesas s arba ciklai , ko pasekoje sistema grįžta į pradinę būseną.
Grafikuose pusiausvyros procesai vaizduojami kaip kreivės. Paprastai nepusiausvyros procesai negali būti pavaizduoti kreivėmis, nes parametrai neturi apibrėžtos reikšmės.
Taip pat atkreipiame dėmesį, kad griežtai sakydamas kiekybinės termodinamikos išvados taikomos tik pusiausvyros būsenoms ir grįžtamiems procesams . Tačiau daugeliu atvejų realūs procesai, kurie jokiu būdu nėra pusiausvyros, labai tiksliai aprašomi termodinamikos dėsniais.
valstybė. Būsenos samprata dažniausiai apibūdina momentinę nuotrauką, sistemos „pjūvį“, jos raidos stotelę. Jis nustatomas arba per įvesties įtakas ir išėjimo signalus (rezultatus), arba per sistemos savybes, parametrus (pavyzdžiui, slėgis, greitis, pagreitis – fizinėms sistemoms; našumas, gamybos sąnaudos, pelnas – ekonominėms sistemoms).
Taigi būsena yra esminių savybių rinkinys, kurį sistema turi tam tikru laiko momentu.
Galimos realios sistemos būsenos sudaro leistinų sistemos būsenų aibę.
Būsenų skaičius (būsenų aibės galia) gali būti baigtinis, skaičiuojamas (būsenų skaičius matuojamas diskretiškai, bet jų skaičius yra begalinis); galios kontinuumas (būsenos kinta nuolat, o jų skaičius yra begalinis ir nesuskaičiuojamas).
Būsenas galima apibūdinti per būsenos kintamieji. Jei kintamieji yra diskretūs, būsenų skaičius gali būti baigtinis arba skaičiuojamas. Jei kintamieji yra analoginiai (nepertraukiami), tada galia yra tęstinė.
Iškviečiamas minimalus kintamųjų skaičius, per kurį galima nurodyti būseną fazinė erdvė. Sistemos būklės pokyčiai rodomi fazinėje erdvėje fazės trajektorija.
Elgesys. Jei sistema gali pereiti iš vienos būsenos į kitą (pvz. s 1 →s 2 →s 3 → ...), tada jie sako, kad turi elgesį. Ši sąvoka naudojama, kai perėjimo iš vienos būsenos į kitą modeliai (taisyklės) nežinomi. Tada jie sako, kad sistema turi tam tikrą elgesį, ir išsiaiškina jos prigimtį.
Pusiausvyra. Sistemos gebėjimas, kai nėra išorinių trikdančių poveikių (arba esant nuolatiniam poveikiui), išlaikyti savo būseną neribotą laiką. Ši būsena vadinama pusiausvyros būsena.
Tvarumas. Sistemos gebėjimas grįžti į pusiausvyros būseną, kai ji buvo pašalinta iš šios būsenos, veikiant išoriniams (o sistemose su aktyviais elementais - vidiniais) trikdančiais poveikiais.
Pusiausvyros būsena, į kurią sistema gali grįžti, vadinama stabilia pusiausvyros būsena.
Plėtra. Plėtra paprastai suprantama kaip sistemos sudėtingumo padidėjimas, prisitaikymo prie išorinių sąlygų pagerėjimas. Dėl to atsiranda nauja objekto kokybė arba būsena.
Patartina išskirti specialią besivystančių (savaime besiorganizuojančių) sistemų klasę, kurios turi ypatingų savybių ir reikalauja specialių jų modeliavimo metodų.
Sistemos įėjimaix i- tai įvairūs išorinės aplinkos įtakos sistemai taškai (1.3 pav.).
Sistemos įvestis gali būti informacija, materija, energija ir kt., kurios yra transformuojamos.
Apibendrinta įvestis ( X) įvardykite kokią nors (bet kurią) visų būseną r sistemos įėjimai, kurie gali būti pavaizduoti kaip vektorius
X = (x 1 , x 2 , x 3 , …, x k, …, x r).
Sistemos išėjimaiy i- tai įvairūs sistemos įtakos išorinei aplinkai taškai (1.3 pav.).
Sistemos produkcija yra informacijos, materijos ir energijos transformacijos rezultatas.
Sistemos judėjimas yra nuoseklaus savo būsenos kaitos procesas.
Panagrinėkime sistemos būsenų priklausomybes nuo sistemos įėjimų, jos būsenų (perėjimų) ir išėjimų funkcijų (būsenų).
Sistemos būklė Z(t) bet kada t priklauso nuo įėjimų funkcijos X(t), taip pat iš ankstesnių būsenų (t– 1), (t– 2), ..., t.y. nuo savo būsenų funkcijų (perėjimų)
Z(t) = F c , (1)
Kur Fc– sistemos būsenos (perėjimų) funkcija.
Ryšys tarp įvesties funkcijos X(t) ir išėjimo funkcija Y (t) sistemos, neatsižvelgiant į ankstesnes būsenas, gali būti pavaizduotos formoje
Y(t) = Fв [X(t)],
Kur F in– sistemos išėjimų funkcija.
Sistema su tokia išvesties funkcija vadinama statinis.
Jei sistemos išėjimas priklauso ne tik nuo įėjimų funkcijų X(t), bet ir apie būsenų funkcijas (perėjimus) Z( t – 1), Z(t– 2), ..., tada
vadinamos sistemos su tokia išvesties funkcija dinamiškas(arba sistemos su elgesiu).
Priklausomai nuo sistemų įėjimų ir išėjimų funkcijų matematinių savybių, skiriamos diskrečios ir tolydžios sistemos.
Ištisinėms sistemoms išraiškos (1) ir (2) atrodo taip:
 (4)
(4)
(3) lygtis nustato sistemos būseną ir vadinama sistemos būsenų lygtimi.
(4) lygtis nustato stebimą sistemos išvestį ir vadinama stebėjimo lygtimi.
Funkcijos Fc(sistemos būsenų funkcija) ir F in(išvesties funkcija) atsižvelgti ne tik į esamą būseną Z(t), bet ir ankstesnes būsenas Z(t – 1), Z(t – 2), …, Z(t – v) sistemos.
Ankstesnės būsenos yra sistemos „atminties“ parametras. Todėl vertė v apibūdina sistemos atminties tūrį (gylį).
Sisteminiai procesai yra nuoseklių sistemos būklės pokyčių visuma, siekiant tikslo. Sistemos procesai apima:
– įvesties procesas;
– išvesties procesas;
Molekulinis kinetinis požiūris. Molekulinė fizika remiasi dviem pagrindiniais principais:
bet koks kūnas – kietas, skystas ar dujinis – susideda iš izoliuotų dalelių, kurias vadiname molekulėmis (atomais, jonais ir kt.);
bet kurios medžiagos dalelės yra atsitiktiniu chaotišku judėjimu, kuris, nesant išorinės jėgos poveikio, neturi jokios pirmenybės krypties. Šis judėjimas vadinamas terminis, nes nuo jo intensyvumo priklauso medžiagos temperatūra.
Pirmoje pastraipoje kaip dalelės, iš kurių gali sudaryti medžiaga, be elektriškai neutralių atomų ir molekulių, minimos ir elektriškai įkrautos dalelės – jonai. Visų pirma, tai labai svarbus plazminės medžiagos būsenos atvejis. Remiantis turimais skaičiavimais, maždaug 95% matomos medžiagos Visatoje yra plazmos būsenoje. Be to, tirpaluose, pavyzdžiui, valgomojoje druskoje vandenyje, ištirpusi medžiaga egzistuoja jonų pavidalu, o metalai yra teigiamų jonų, svyruojančių aplink pusiausvyros padėtis (kristalinės gardelės mazgai), ir laisvųjų elektronų, sudarančių elektronų dujas, rinkinys. . Ateityje pagrindinis dėmesys bus skiriamas „įprastai“ materijos būsenai, kai ją sudarančios dalelės yra elektriškai neutralios. Plazma, kaip ypatinga medžiagos būsena, tirpalai ir metalai bus nagrinėjami atskirai. Antroje pastraipoje rašoma: „ atsitiktiniu chaotišku judėjimu, kuris, nesant išorinių jėgų įtakos, neturi jokios pirmenybės krypties. o nesusietas su išoriniais jėgos laukais.. Tokio pobūdžio situacijų svarstymas nepatenka į šio skyriaus taikymo sritį.
Molekulinės kinetinės teorijos tikslas – aiškinti tas medžiagos savybes, kurios tiesiogiai stebimos eksperimentiškai (klampumas, šilumos laidumas ir kt.), kaip bendrą molekulių veikimo rezultatą. Tai darydama ji naudoja statistinį metodą, domisi ne kiekvienos atskiros molekulės judėjimu, o tik tokiomis vidutinėmis vertėmis, kurios apibūdina viso molekulių rinkinio judėjimą ir sąveiką. Molekulinė kinetinė teorija veikia su pagrindiniais fizikos dėsniais mikroskopinis lygis - klasikinės mechanikos, elektrodinamikos ir tt dėsniai. Todėl jis gali numatyti daugelio fizikinių sistemos parametrų reikšmes, remdamasis, kaip sakoma, pirmaisiais principais. Šiame skyriuje aptarsime gerai žinomų idealių dujų dėsnių išvedimą remiantis molekuline kinetikos teorija.
Sistemos būklė. Bet kurioje fizikos šakoje reiškinių tyrimas pradedamas identifikuojant kūnų rinkinį, kuris vadinamas sistema.
Įsivaizduokime, pavyzdžiui, dujas (sistemą) uždarame cilindre po stūmokliu (terpe), pav. 1.1.

Ryžiai. 1.1. Dujos uždarame cilindre po stūmokliu
Pakeitus stūmoklio padėtį arba cilindro sienelių temperatūrą, pasikeičia sistemos būsena.
Tokių paprastų sistemų kaip dujos būsena apibūdinama šiais makroskopiniais parametrais: tūris, slėgis, temperatūra . Natūralu, kad mums reikia ir parametrų, kurie apibrėžia sistemą – jos masę m,santykinė molekulinė masė M(arba molinė masė m).
Iš viso keturios vertės: apimtis , spaudimas , temperatūros, svoris. Arba, atsižvelgiant į žinomą sistemos medžiagos molio masę, molių skaičių. Jei sistema yra įvairių medžiagų mišinys, tuomet reikia pridėti santykines mišinio komponentų koncentracijas: ![]() , čia yra medžiagos masė. Akivaizdu, kad pastaruoju atveju yra ne keturi parametrai, o daugiau.
, čia yra medžiagos masė. Akivaizdu, kad pastaruoju atveju yra ne keturi parametrai, o daugiau.
Prisiminkime tai
Kitas – lygiavertis – apgamo apibrėžimas yra toks:
Atkreipkite dėmesį, kad šiuolaikinis Avogadro skaičiaus apibrėžimas teigia, kad Avogadro skaičius yra lygus izotopo 12 atomų skaičiui C yra 0,012 kilogramo anglies-12. Taigi, apgamas gali būti apibrėžtas taip:
Sprendžiant uždavinius, santykinės molekulinės masės reikšmės M elementai paimti iš periodinės lentelės. Molinę masę lengva apskaičiuoti:
![]()
Pavyzdžiui, dėl aukso
![]()
Sudėtingoms medžiagoms būtina atlikti paprastas aritmetines operacijas, pavyzdžiui, su anglies dioksidu:
Paprastai tariant, sistemos parametrai, tokie kaip slėgis, temperatūra, medžiagos tankis ![]() skirtinguose taškuose gali turėti skirtingas reikšmes. Tokiu atveju sistemai kaip visumai negali būti priskirtos tam tikros šių parametrų reikšmės, sistema yra nepusiausvyros būsena.
Tačiau patirtis rodo, kad jei išorinės sąlygos nesikeičia, galiausiai sistema susitvarko pusiausvyros būsena:
atskirų jo dalių slėgiai ir temperatūros yra suvienodinami, todėl sistemos parametrai įgauna tam tikras vertes, kurios išlieka pastovios neribotą laiką. Tokiu atveju išorinės sąlygos turi būti tokios, kad sistemoje nebūtų medžiagos, energijos, impulso ir pan.
skirtinguose taškuose gali turėti skirtingas reikšmes. Tokiu atveju sistemai kaip visumai negali būti priskirtos tam tikros šių parametrų reikšmės, sistema yra nepusiausvyros būsena.
Tačiau patirtis rodo, kad jei išorinės sąlygos nesikeičia, galiausiai sistema susitvarko pusiausvyros būsena:
atskirų jo dalių slėgiai ir temperatūros yra suvienodinami, todėl sistemos parametrai įgauna tam tikras vertes, kurios išlieka pastovios neribotą laiką. Tokiu atveju išorinės sąlygos turi būti tokios, kad sistemoje nebūtų medžiagos, energijos, impulso ir pan.
Paprastumo dėlei panagrinėkime sistemą, kurios bendra masė nekinta, jos sudėtis ir santykinės ją sudarančių medžiagų koncentracijos nesikeičia. Taip atsitinka, pavyzdžiui, kai sistemoje nevyksta jokios cheminės reakcijos. Su bendresniu požiūriu: sistemoje nėra ją sudarančių dalelių kūrimo ir naikinimo procesų. Pavyzdžiui, vandens molekulių susidarymo iš deguonies ir vandenilio molekulių reakcija
![]()
gali būti vertinamas kaip dalelių naikinimo ir dalelių gimimo procesas. Kai kuriais atvejais, pavyzdžiui, fotonų dujose (šiluminė spinduliuotė), dalelių kūrimo ir naikinimo procesų buvimas yra labai svarbus.
Papildoma informacija
http://www.femto.com.ua/articles/part_2/4471.html – Fizinė enciklopedija. Cheminis potencialas: fizikinis dydis, būtinas termodinaminių sistemų, turinčių kintamą dalelių skaičių, savybėms apibūdinti;
http://www.femto.com.ua/articles/part_1/0017.html – Fizinė enciklopedija. Avogadro dėsnis;
http://marklv.narod.ru/mkt/mkt.htm - Mokyklinė pamoka su paveikslėliais apie molekulinę kinetinę hipotezę;
Kaip bus matyti vėliau, norint visiškai apibūdinti tokios sistemos pusiausvyros būseną, pakanka tik trijų parametrų: . Be to, jei būsena yra pusiausvyra, tai yra ryšys tarp šių trijų parametrų: duoti du sistemos parametrai (pavyzdžiui, jos temperatūra ir tūris) vienareikšmiškai lemia trečiąjį (šiuo atveju slėgį). Matematiškai šį ryšį galima apibūdinti sistemos būsenos lygtis
![]() ,
,
kur yra konkretus funkcijos tipas F priklauso nuo sistemos savybių. Pavyzdys yra lygtys Clapeyronas - Mendelejevas tobulam arba van der Waalsas neidealioms dujoms (šios lygtys bus aptariamos toliau).
Taigi, val pusiausvyros sistema su pastovia mase, sudėtimi ir santykinėmis koncentracijomis jo sudedamosios dalys – ateityje to nenurodysime kiekvieną kartą – Yra tik du nepriklausomi parametrai o jo pusiausvyros būsena gali būti grafiškai pavaizduota tašku plokštumoje (1.2 pav.), kur bet kurie du iš trijų parametrų yra pavaizduoti išilgai ašių - , arba :

Ryžiai. 1.2. Sistemos pusiausvyros būsenos diagramose (p, V), (p, T) ir (V, T)
|
Procesas yra bet koks sistemos perėjimas iš vienos būsenos į kitą. |
Procesas visada yra susijęs su sistemos būsenos termodinaminės pusiausvyros pažeidimu. Šiuo metu termodinaminės pusiausvyros būsena pakanka suprasti būseną, kurioje nėra visų įmanomų energijos mainų procesų: 1) nė vienas sistemos posistemis nedirba kitose posistemėse; 2) nė vienas sistemos posistemis nekeičia šilumos su kitais sistemos posistemiais; 3) nė vienas sistemos posistemis nesikeičia dalelėmis su kitais sistemos posistemiais. Kaip bus matyti vėliau, kitų tipų energijos mainai įprastuose (kuriuose nėra dalelių kūrimo ir naikinimo procesų) neegzistuoja. Iš čia galiausiai išplaukia, kad pakanka nurodyti tik tris nepriklausomus parametrus (pavyzdžiui: dalelių skaičių, tūrį ir vidinę energiją), kad būtų galima apibūdinti vieno komponento sistemos termodinaminės pusiausvyros būseną.
Jei sistemos būsena laikui bėgant keičiasi, tada sistemoje vyksta kažkoks procesas. Priešingai, paprastai kalbant, nėra tiesa: sistemos būsena gali ir nepasikeisti, nors joje vyksta procesas – stacionari, bet nepusiausvyra sistemos būsena. Pavyzdžiui, vykstant stacionariam šilumos perdavimo procesui, sistemos būsena yra nepusiausvyra, nors ji išlieka nepakitusi ta prasme, kad temperatūros, slėgio, tankio ir kt. pasiskirstymai visame sistemos tūryje nekinta.
Esant be galo lėtam procesui, galime daryti prielaidą, kad bet kuriuo laiko momentu sistemos būsena yra pusiausvyra. Fiziškai tai reiškia, kad būdingas proceso laikas yra daug ilgesnis nei laikas, reikalingas pusiausvyrai sistemoje nustatyti, kuris dar vadinamas atsipalaidavimo laiku. . Šis procesas vadinamas pusiausvyros procesas.
Akivaizdu, kad pusiausvyros procesas yra dar vienas idealizavimas. Kad procesas būtų laikomas - su tam tikru baigtiniu tikslumu - pusiausvyra, būtina, kad nelygybė
ir kuo geriau jis atliekamas, tuo procesas arčiau pusiausvyros.
Pusiausvyros procesas gali būti laikomas pusiausvyros būsenų seka. Ateityje bus tiriami tik pusiausvyros procesai (jei konkrečiai nenurodyta kitaip).
Kadangi sistemos būsena vaizduojama tašku diagramoje, o procesas yra pusiausvyros būsenų seka, toks procesas diagramoje pavaizduotas linija. Kiekvienas tiesės taškas yra sąlyginai pusiausvyros tarpinė sistemos būsena. Pusiausvyros procesas yra procesas grįžtamasis, tai yra, jis gali tekėti priešinga kryptimi, eidamas per tas pačias tarpines būsenas atvirkštine tvarka, aplinkiniuose kūnuose neliekant jokių pakitimų.
Natūralu, kad tada sistemoje neturėtų veikti jėgos, panašios į trinties jėgas. Žemiau susipažinsime su diagramomis, apibūdinančiomis kai kuriuos charakteringus procesus termodinaminėse sistemose.
Žinodami sistemos būklę, galime rasti įvairių valstybines funkcijas - fizinės charakteristikos, kurios priklauso tik nuo sistemos būsenos, tai yra, jos įgyja tas pačias reikšmes, kai tik sistema atsiduria tam tikroje būsenoje, nepaisant ankstesnės jos istorijos.
Temperatūra. Bet kuri sistema turi tam tikrą rezervą vidinė energija, nesusiję su visos sistemos padėtimi ar judėjimu išorinės aplinkos atžvilgiu. Apie vidinę energiją kalbėsime plačiau, bet kol kas tereikia intuityvaus supratimo, kad išmetę kiaušinį kokiu nors greičiu jo neiškepsime, nors kiaušinio kinetinė energija padidės. Norint išvirti minkštai virtą kiaušinį, jo nereikia mesti, o pašildyti.
Siekiant kiekybiškai apibūdinti vidinę energiją, įvedama sąvoka temperatūros. Temperatūra užima ypatingą vietą tarp fizikinių dydžių. Patirtis rodo, kad ji apibūdina kūnų šiluminės pusiausvyros būseną. Jei susiliečia du skirtingos temperatūros kūnai, dėl molekulių sąveikos šie kūnai keisis energija. Po kurio laiko temperatūra išsilygins ir šilumos perdavimas sustos, atsiras šiluminės pusiausvyros būsena. Šiluminės pusiausvyros būsena yra būsena, į kurią laikui bėgant pereina bet kuri izoliuota sistema.
Įprasti temperatūros nustatymo metodai yra pagrįsti daugelio kūnų savybių (tūrio, slėgio ir kt.) priklausomybe nuo jos. Šiuo atveju pasirenkamas termometrinis korpusas ir temperatūros skalės gradacija. Labiausiai paplitusi yra laipsnių skalė (Celsijaus skalė, 1.3 pav.).

Ryžiai. 1.3. Celsijaus laipsnių skalė
Šios skalės atkarpa tarp užšalimo taško (vandens kristalizacijos arba, kas yra tas pats, ledo tirpimo) ir vandens virimo temperatūros esant normaliam atmosferos slėgiui, padalinta į 100 lygių dalių. Ši dalis vadinama laipsnių Celsijaus(žymimas t °C). Taigi vandens kristalizacijos taškas atitinka 0 °C ir virimo temperatūra - 100 °C. Pabrėžiame, kad tiek esant normaliam 760 mm Hg slėgiui. Art. JAV jie taip pat naudoja Farenheito skalę (žymima t °F). Savo skalės nuliui Farenheitas pasirinko žemiausią temperatūrą, kurią galėjo atkurti savo laboratorijoje – druskos ir ledo mišinio lydymosi temperatūrą. Vandens užšalimo taškas šioje skalėje atitinka temperatūrą 32 °F ir virimo temperatūra - 212°F.Šis intervalas padalintas ne į šimtą, o į 180 dalių (panašiai kaip kampiniai laipsniai). Todėl Farenheito laipsnis yra mažesnis nei Celsijaus laipsnis (faktorius 100/180 = 5/9 ). Santykis tarp temperatūrų šiose dviejose skalėse pateikiamas formulėmis


Ryžiai. 1.4. Skalių atitikimas
Fizikoje jie naudoja termodinaminę (senas pavadinimas: absoliuti) temperatūros skalę (Kelvino skalė), kuri nepriklauso nuo termometrinio kūno, bet yra nustatyta termodinamikos dėsnių pagrindu.
Šiuo metu vienas kelvinas apibrėžiamas taip: kelvinas yra termodinaminės temperatūros vienetas, lygus vandens trigubo taško termodinaminės temperatūros daliai. Trigubas vandens taškas pasirinktas vietoj jo virimo, nes trigubo taško temperatūra nepriklauso nuo slėgio ir yra tiksliau nustatoma. Pagal Celsijaus skalę trigubas vandens taškas atitinka temperatūrą. Vieno kelvino reikšmė (žymima K) yra tokia pati kaip Celsijaus laipsnio vertė. Atsižvelgdami į nurodytą 0,01 kelvino skirtumą, norėdami susieti temperatūras termodinaminėje skalėje ir Celsijaus laipsnių skalėje, gauname
Būdingų temperatūrų gamtoje pavyzdžiai parodyti fig. 1.5.

Ryžiai. 1.5. Įvairių fizikinių procesų temperatūra
Papildoma informacija
http://kvant.mirror1.mccme.ru/1990/08/temperatura_teplota_termometr.htm – Žurnalas „Kvant“, 1990 Nr. 8, p. 10–19, A. Kikoinas, Temperatūra, šiluma, termometras;
Ar žinai fiziką? Biblioteka „Kvantas“, 82 numeris, Mokslas, 1992 m. Puslapis 130, 113, 115 klausimai apie temperatūros skalių vienodumą (atsakymas p. 136–138);
http://ilib.mirror1.mccme.ru/djvu/bib-kvant/kvant_82.htm – Perelman Ya.I. - Ar tu žinai fiziką? Biblioteka „Kvantas“, 82 numeris, Mokslas, 1992 m. Puslapis 130, 112 klausimas: Farenheito temperatūros skalės kilmė (atsakymas žr. 135–136 psl.);
http://www.femto.com.ua/articles/part_2/4070.html – Fizinė enciklopedija. Aprašomi prietaisai, skirti matuoti temperatūrą nuo aukščiausios iki žemiausios.

Ryžiai. 1.6. Karštos arbatos puodelio termograma
| Parametrų pavadinimas | Reikšmė |
| Straipsnio tema: | Sistemos būklė |
| Rubrika (teminė kategorija) | Išsilavinimas |
Apibrėžimas 1.6 Sistemos būsena vadinamas parametrų rinkiniu, kuris kiekvienu nagrinėjamu laiko momentu atspindi reikšmingiausius tam tikru požiūriu sistemos elgsenos ir jos veikimo aspektus.
Apibrėžimas yra labai bendras. Jame pabrėžiama, kad būsenos charakteristikų pasirinkimas priklauso nuo tyrimo tikslų. Paprasčiausiais atvejais būseną galima įvertinti vienu parametru, kuris gali turėti dvi reikšmes (įjungta arba išjungta, 0 arba 1). Atliekant sudėtingesnius tyrimus, būtina atsižvelgti į daugybę parametrų, kurie gali įgyti daug reikšmių.
Paprastai vadinama sistema, kurios būsena bėgant laikui keičiasi veikiant tam tikriems priežasties-pasekmės ryšiams dinamiškas sistema, priešingai nei statinė sistema, kurios būsena laikui bėgant nekinta.
Norima sistemos būsena pasiekiama arba palaikoma atitinkamais valdymo veiksmais.
Kontrolė
Kibernetikoje kontrolė suvokiama kaip kryptingo sistemos būsenos keitimo procesas. Kartais kontrolė yra suvoktos informacijos apdorojimas signalais, kurie nukreipia mašinų ir organizmų veiklą. O informacijos suvokimo, jos saugojimo, perdavimo ir atgaminimo procesai priklauso komunikacijos sričiai. Taip pat yra platesnis vadybos sampratos aiškinimas, apimantis visus valdymo veiklos elementus, vienijamus tikslo vienybės ir sprendžiamų uždavinių bendrumo.
Apibrėžimas 1.7 Valdymas Informaciniu procesu įprasta vadinti kryptingo poveikio realaus pasaulio objektams ir procesams rengimą ir palaikymą.
Šis aiškinimas apima visus klausimus, kuriuos turi spręsti valdymo organas – nuo informacijos rinkimo, sistemos analizės, sprendimų priėmimo, priemonių sprendimams įgyvendinti planavimo iki valdymo signalų generavimo ir perdavimo vykdomiesiems organams.
Sistemos būklė – samprata ir tipai. Kategorijos „Sistemos būsena“ klasifikacija ir ypatybės 2017, 2018 m.
Išorinės aplinkos samprata Sistema egzistuoja tarp kitų materialių objektų, kurie į ją neįeina. Juos vienija sąvoka „išorinė aplinka“ – išorinės aplinkos objektai. Išorinė aplinka – erdvėje ir laike egzistuojančių objektų (sistemų) visuma, kuri... [skaityti plačiau] .
Biomedicininė temos reikšmė
Termodinamika – fizinės chemijos šaka, tirianti bet kokias makroskopines sistemas, kurių būsenos pokyčiai yra susiję su energijos perdavimu šilumos ir darbo pavidalu.
Cheminė termodinamika yra teorinis bioenergijos pagrindas – mokslas apie energijos transformacijas gyvuose organizmuose ir specifines vienos rūšies energijos virsmo kita ypatybes gyvybės procese. Gyvame organizme yra glaudus ryšys tarp medžiagų apykaitos ir energijos procesų. Metabolizmas yra visų gyvybės procesų energijos šaltinis. Bet kokių fiziologinių funkcijų įgyvendinimas (judėjimas, pastovios kūno temperatūros palaikymas, virškinimo sulčių išsiskyrimas, įvairių kompleksinių medžiagų sintezė organizme iš paprastesnių ir kt.) reikalauja energijos sąnaudų. Visų rūšių energijos šaltinis organizme yra maistinės medžiagos (baltymai, riebalai, angliavandeniai), kurių potenciali cheminė energija medžiagų apykaitos proceso metu paverčiama kitų rūšių energija. Pagrindinis būdas išlaisvinti cheminę energiją, reikalingą gyvybinei organizmo veiklai palaikyti ir fiziologinėms funkcijoms vykdyti, yra oksidaciniai procesai.
Cheminė termodinamika leidžia nustatyti ryšį tarp energijos sąnaudų, kai žmogus atlieka tam tikrą darbą, ir maistinių medžiagų kaloringumo, taip pat leidžia suprasti biosintezės procesų, vykstančių dėl energijos, išsiskiriančios oksiduojantis maistinėms medžiagoms, energetinę esmę.
Standartinių termodinaminių dydžių žinojimas santykinai nedideliam junginių skaičiui leidžia atlikti įvairių biocheminių procesų energetinių charakteristikų termocheminius skaičiavimus.
Termodinamikos metodų naudojimas leidžia kiekybiškai įvertinti baltymų, nukleorūgščių, lipidų ir biologinių membranų struktūrinių transformacijų energiją.
Gydytojo praktiniame darbe termodinaminiai metodai plačiausiai taikomi nustatant bazinės apykaitos intensyvumą esant įvairioms fiziologinėms ir patologinėms organizmo būklėms, taip pat nustatant maisto produktų kaloringumą.
Cheminės termodinamikos problemos
1. Cheminių ir fizikinių ir cheminių procesų energetinio poveikio nustatymas.
2. Savaiminio cheminių ir fizikinių bei cheminių procesų atsiradimo kriterijų nustatymas.
3. Termodinaminių sistemų pusiausvyros būsenos kriterijų nustatymas.
Pagrindinės sąvokos ir apibrėžimai
Termodinaminė sistema
Kūnas arba kūnų grupė, atskirta nuo aplinkos realia arba įsivaizduojama sąsaja, vadinama termodinamine sistema.
Atsižvelgiant į sistemos gebėjimą keistis energija ir medžiaga su aplinka, išskiriamos izoliuotos, uždaros ir atviros sistemos.
Izoliuotas Sistema yra sistema, kuri nesikeičia nei medžiaga, nei energija su aplinka.
Sistema, kuri keičiasi energija su aplinka ir nesikeičia medžiaga, vadinama uždaryta.
Atvira sistema yra sistema, kuri keičiasi medžiaga ir energija su aplinka.
Sistemos būsena, standartinė būsena
Sistemos būseną lemia jos fizikinių ir cheminių savybių visuma. Kiekvienai sistemos būsenai būdingos tam tikros šių savybių reikšmės. Jeigu šios savybės keičiasi, tai keičiasi ir sistemos būsena, tačiau jei sistemos savybės laikui bėgant nekinta, tai sistema yra pusiausvyros būsenoje.
Norint palyginti termodinaminių sistemų savybes, būtina tiksliai nurodyti jų būseną. Tam tikslui buvo įvesta sąvoka – standartinė būsena, kai atskiras skystis arba kietas daiktas yra fizinė būsena, kurioje jie egzistuoja esant 1 atm (101315 Pa) slėgiui ir tam tikrai temperatūrai.
Dujoms ir garams standartinė būsena atitinka hipotetinę būseną, kai 1 atm slėgio dujos tam tikroje temperatūroje paklūsta idealių dujų dėsniams.
Reikšmės, susijusios su standartine būsena, rašomos apatiniu indeksu „o“, o indeksas nurodo temperatūrą, dažniausiai 298K.
Būsenos lygtis
Lygtis, nustatanti funkcinį ryšį tarp savybių, lemiančių sistemos būseną, verčių, vadinama būsenos lygtimi.
Jei žinoma sistemos būsenos lygtis, tai norint apibūdinti jos būseną, nebūtina žinoti visų sistemos savybių skaitinių reikšmių. Pavyzdžiui, Clapeyrono – Mendelejevo lygtis yra idealių dujų būsenos lygtis:
kur P – slėgis, V – tūris, n – idealių dujų molių skaičius, T – jų absoliuti temperatūra ir R – universali dujų konstanta.
Iš lygties išplaukia, kad norint nustatyti idealių dujų būseną, pakanka žinoti bet kurių trijų iš keturių dydžių P, V, n, T skaitines reikšmes.
Būsenos funkcijos
Savybės, kurių reikšmės sistemos perėjimo iš vienos būsenos į kitą metu priklauso tik nuo pradinės ir galutinės sistemos būsenos ir nepriklauso nuo perėjimo kelio, vadinamos būsenos funkcijomis. Tai apima, pavyzdžiui, slėgį, tūrį, sistemos temperatūrą.
Procesai
Sistemos perėjimas iš vienos būsenos į kitą vadinamas procesu. Atsižvelgiant į atsiradimo sąlygas, išskiriami šie procesų tipai.
Apvalus arba ciklinis– procesas, kurio metu sistema grįžta į pradinę būseną. Pasibaigus žiediniam procesui, bet kurios sistemos būsenos funkcijos pokyčiai yra lygūs nuliui.
Izoterminis– procesas, vykstantis esant pastoviai temperatūrai.
Izobarinis– procesas, vykstantis esant pastoviam slėgiui.
Izochorinis– procesas, kurio metu sistemos tūris išlieka pastovus.
Adiabatinis– procesas, vykstantis be šilumos mainų su aplinka.
Pusiausvyra– procesas, laikomas nuolatine sistemos pusiausvyros būsenų seka.
Nepusiausvyra– procesas, kurio metu sistema pereina nepusiausvyros būsenas.
Grįžtamasis termodinaminis procesas– procesas, po kurio sistema ir su ja (aplinka) sąveikaujančios sistemos gali grįžti į pradinę būseną.
Negrįžtamas termodinaminis procesas– procesas, po kurio sistema ir su ja (aplinka) sąveikaujančios sistemos negali grįžti į pradinę būseną.
Pastarosios sąvokos plačiau aptariamos skyriuje „Cheminės pusiausvyros termodinamika“.
Panašūs straipsniai